消毒薬の選び方
各種微生物に対する消毒薬の選び方
多剤耐性緑膿菌
多剤耐性緑膿菌(MDRP)、MRSAおよびバンコマイシン耐性腸球菌(VRE)などの多剤耐性菌では、治療が行いにくいといった問題がある。とくに、これらのうちのMDRPでは、市販の抗菌薬のいずれもが無効な超多剤耐性菌も存在している1,2)。すなわち、この超多剤耐性菌では、選択すべき抗菌薬が見当たらないという大問題がある。したがって、MDRPの感染防止は特に重要である。
(1)感染経路
MDRPの感染経路は「感染患者→医療従事者の手指→患者」や「環境→患者」などのパターンがあり、前者のパターンでは手洗いや手指消毒が、また後者のパターンでは用具や環境の清潔保持が重要になる。
(2)有効な消毒法
緑膿菌には原則的にすべての消毒薬が有効である3,4)。たとえば、0.1%塩化ベンザルコニウムや0.01%(100ppm)次亜塩素酸ナトリウムは、緑膿菌を30秒以内に殺滅する。ただし、バイオフィルム形成の緑膿菌に対しては消毒薬は効きにくくなる。たとえば、バイオフィルム形成の緑膿菌の殺滅には、0.1%塩化ベンザルコニウムや0.01%(100ppm)次亜塩素酸ナトリウムで30分間が必要である(表1)3)。また、塩化ベンザルコニウム含浸綿球が緑膿菌汚染を受けやすいように(図1)、状況によっては低水準消毒薬が緑膿菌に無効なこともある4,5)。したがって、緑膿菌の消毒には、次亜塩素酸ナトリウムや消毒用エタノールなどの中水準消毒薬を選択するほうが望ましい。
また、緑膿菌に対しては80℃・10秒間や70℃・30秒間の熱水も有効である。
表1. バイオフィルム形成緑膿菌に対する消毒薬の効果(22±2°C)
| 消毒薬 | 濃度 (%) |
接触後の生菌数(対数値:平均±標準偏差) | |||
|---|---|---|---|---|---|
| 1分 | 10分 | 30分 | 60分 | ||
| クロルヘキシジン | 0.1 | 2.87±1.07(7) <1.4(2) |
2.61±0.93(5) <1.4(4) |
2.51±0.97(4) <1.4(5) |
1.94±0.69(4) <1.4(5) |
| 0.2 | 2.24(1) <1.4(2) |
1.63±0.24(2) <1.4(4) |
<1.4(6) | ||
| 0.3 | 1.69(2)< 1.4(2) |
<1.4(6) | <1.4(6) | ||
| 0.4 | <1.4(6) | <1.4(6) | <1.4(6) | ||
| 0.5 | <1.4(12) | <1.4(12) | <1.4(12) | <1.4(12) | |
| 塩化ベンザルコニウム | 0.1 | 2.87±0.62(3) <1.4(6) |
2.87±0.62(3) <1.4(9) |
<1.4(6) | |
| 0.5 | 1.40(1) <1.4(5) |
<1.4(6) | <1.4(6) | ||
| 両性界面活性剤 | 0.1 | 4.95±0.73(6)* <1.4(0) |
4.32±1.19(6)* <1.4(0) |
4.03±1.28(6)* <1.4(0) |
3.24±0.26(5)* <1.4(1) |
| 0.5 | 2.70±0.79(7) <1.4(2) |
2.75±0.45(2) <1.4(7) |
2.49±0.77(4) <1.4(5) |
2.69(1)<1.4(8) | |
| 次亜塩素酸ナトリウム | 0.01 | 2.55±1.17(7) <1.4(5) |
4.28±0.89(2) <1.4(13) |
<1.4(12) | <1.4(6) |
| 0.1 | 2.18(1) <1.4(8) |
<1.4(9) | |||
| ポビドンヨード | 1 | 1.54±0.15(2) <1.4(6) |
<1.4(6) | ||
| グルタラール | 2 | <1.4(6) | <1.4(6) | ||
* 対照値(5.28 ± 0.47),34回の実験)と比べて有意差なし
( )内は実験回
図1. 0.02%塩化ベンザルコニウム含浸綿球の緑膿菌汚染例
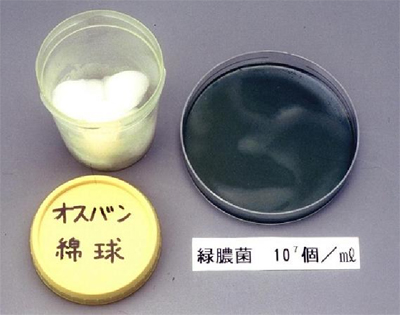
3か月間にわたる分割・つぎ足し使用を行っていた
環境
緑膿菌は流し台や風呂場などの湿潤環境に存在する。したがって、流し台の付近ではミキシング(混合調製)台などへの水道水のはね返りに対する注意が必要である。ただし、流し台の消毒は必ずしも必要でない。一方、風呂場では、使用後に乾燥させる必要がある。また、病院ではシャワー浴の利用が望ましい。
図2に、緑膿菌がとくに住みつきやすい用具の例を示した6-11)。
図2. 緑膿菌の住み家となりやすい用具例
 |
 |
 |
| スポンジ | スポンジ様材質(ポリウレタンフォーム)の 浴用イスなど |
剃毛用ハケ |
手指
速乾性手指消毒薬が有効である12)。ゲル剤および液剤のいずれを用いてもよい。なお、塩化ベンザルコニウムやクロルヘキシジン(ヒビテン®、マスキン®)などの低水準消毒薬も緑膿菌に有効であるが、ディスペンサー容器などへのこれらの消毒薬のつぎ足し使用は細菌汚染防止の観点から行ってはならない。
用具やリネンの消毒
〈消毒例1〉経管栄養剤の投与セット
経管栄養剤の投与セット(投与チューブやバッグ型投与容器)は、構造的に乾燥しにくい。したがって、これらの投与セットを消毒せずにくり返し使用すると、緑膿菌汚染を招くことがある(図3)9,13,14)。したがって、経管栄養剤の投与チューブやバッグ型投与容器は、使用のつど水洗いして、次回使用時まで0.01%(100ppm)次亜塩素酸ナトリウムに浸漬しておく必要がある。
図3. 投与バッグの緑膿菌汚染例

〝乾燥したつもり〟でくり返し使用していた
〈消毒例2〉超音波ネブライザー
超音波ネブライザーは緑膿菌汚染を受けやすい(図4)。したがって、超音波ネブライザーの薬液カップや蛇管などに対しては、24時間ごとの消毒が必要である14-17)。0.01%(100ppm)次亜塩素酸ナトリウム液への1時間浸漬を行い、その後に食器乾燥器などで乾燥させておく。なお、共用の超音波ネブライザーでそのつどの消毒ができない場合には、逆流防止弁付きマウスピースや逆流防止管付きの鼻管などを患者ごとに交換する方法で対応する。ただし、患者が咳き込んだ場合などでは、そのつどの消毒が必要になる。
また、緑膿菌は湿潤状態の用具のみならず、トマトやホウレン草などの野菜からも検出される32)。したがって、造血幹細胞移植などの易感染患者へ生野菜を出してはならない。
図4. 超音波ネブライザーの吸入液(注射用蒸留水)の緑膿菌汚染例
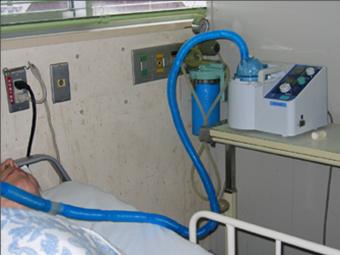

薬液カップなどの消毒を3日間ごとに行っていた。
引用文献
- Oie S, et al: In vitro effects of combination of antipseudomonal agents against seven strains of multidrug-resistant Pseudomonas aeruginosa. J Antimicrob Chemother, 52: 911-914, 2003
- Oie S, et al: In vitro antimicrobial effects of aztreonam, colistin, and the 3-drug combination of aztreonam, ceftazidime and amikacin on metallo-beta-lactamase-producing Pseudomonas aeruginosa. BMC Infect Dis, 10: 123, 2009
- Takeo Y, et al: Efficacy of disinfectants against biofilm cells of Pseudomonas aeruginosa. Microbios, 79: 19-26, 1994
- Oie S, et al: Microbial contamination of antiseptics and disinfectants. Am J Infect Control, 24: 389-395, 1996
- Oie S, et al: Microbial contamination of a disinfectant-soaked unwoven cleaning cloth. J Hosp Infect, 82: 61-63, 2012
- Oie S, et al: Contamination of environmental surfaces by Staphylococcus aureus in a dermatological ward and its preventive measures. Biol Pharm Bull, 28: 120-123, 2005
- Oie S, Kamiya A: Contamination and survival of Pseudomonas aeruginosa in hospitalused sponges. Microbios, 105: 175-181, 2001
- Oie S, et al: Microbial contamination of brushes used for preoperative shaving. J Hosp Infect, 21: 103-110, 1992
- Oie S, et al: Microbial contamination of enteral feeding solution and its prevention. Am J Infect Control, 21: 34-38, 1993
- Oie S, et al: Microbial contamination of antiseptic-soaked cotton balls. Biol Pharm Bull, 20: 667-669, 1997
- Oie S, et al: Microbial contamination of water-soaked cotton gauze and its cause. Microbios, 104: 159-166, 2001
- 尾家重治, 他:新しい潤滑剤を配合した速乾性手指消毒薬の抗菌効果並びに保湿効果. 環境感染, 24: 260-263, 2009
- 尾家重治, 他: 経腸栄養剤の細菌汚染例. Chemotherapy(Tokyo), 40: 743-746, 1992
- Oie S, et al: Comparison of microbial contamination of enteral feeding solution between repeated use of administration sets after washing with water and after washing followed by disinfection. J Hosp Infect, 48: 304-307, 2001
- Tablan OC, et al: Guideline for prevention of nosocomial pneumonia. Part I. Issues on prevention of nosocomial pneumonia-1994. Am J Infect Control, 22: 247-292, 1994
- 足立タツ子, 他: ジェット式ネブライザーの微生物汚染とその消毒法. Chemotherapy , 41: 195-199, 1993
- 河口忠夫, 他: ジェット式ネブライザーの微生物汚染とその対策. 日環感, 23: 221-223, 2008
- Oie S, et al: Microbial contamination of nebulization solution and its measures. Biol Pharm Bull, 29: 503-507, 2006
- Oie S, et al: Microbial contamination of fruit and vegetables and their disinfection. Biol Pharm Bull, 31: 1902-1905, 2008







