消毒薬の選び方
各種微生物に対する消毒薬の選び方
多剤耐性アシネトバクター
アシネトバクター(Acinetobacter spp.)は、緑膿菌などと同様に湿潤環境を好む細菌である1)。しかし、本菌は緑膿菌と異なりヒトの皮膚からも検出される2)。すなわち、アシネトバクターの病院内分布は緑膿菌よりも広いといえる。
アシネトバクターのうち、多剤耐性アシネトバクター(multiple drug-resistant Acinetobacter spp. : 以下MDRAと略す)が、とくに問題となってきている。
(1)感染経路
MDRAのおもな感染経路は接触であり、「MDRA汚染の用具・環境→患者」や「MDRA定着/感染患者→医療従事者の手指→患者」などの経路で感染する3-9)。
(2)有効な消毒法
MDRAに対してはすべての消毒薬が有効である10-14)。また、MDRAは大腸菌やメチシリン耐性黄色ブドウ球菌(MRSA)などと同様に、熱に弱い微生物である。70℃・1分間や80℃・5秒間などの熱水で死滅する。
環境
MDRAにはすべての消毒薬が有効であるが、毒性の観点からグルタラールやフタラールなどの高水準消毒薬を環境消毒に用いてはならない。MDRA汚染を受けた環境表面の消毒には、アルコール、0.01%(100ppm)次亜塩素酸ナトリウム、0.2% 塩化ベンザルコニウムおよび0.2%両性界面活性剤などでの清拭で対応する。
手指
速乾性手指消毒薬が有効である。ゲル剤および液剤のいずれを用いてもよい。また、0.1%塩化ベンザルコニウム液なども有効である。
用具やリネン
耐熱・耐水性の用具やリネンに対しては、熱(熱水、蒸気)が第一選択消毒法である。ウォッシャーディスインフェクタ、フラッシャーディスインフェクタおよび熱水洗濯機などを用いた熱消毒を行う。また、非耐熱性の用具には、消毒薬による消毒を行う。表1には、MDRAの消毒例について示した。
なお、高菌量のアシネトバクター汚染を受けやすい用具や薬液などを図1に示す。消毒せずにくり返し使用されている経管栄養剤の投与セット(バッグ型投与容器、投与チューブ)15)、湿ったままくり返し使用されている口腔ケア用品、壁掛け式吸引装置に用いているチューブ16)、適正な消毒が行われていないネブライザー装置内の吸入液17,18)、人工呼吸器回路内の結露水、超音波加湿器28)、スポンジ20)、剃毛用ハケ21)、室温保管で分割使用されているアロプリノール含嗽液22)、蒸留装置内の蒸留水23)。
図2には、"乾燥したつもり"でくり返し使用を行っていた経管栄養バッグ内の投与残液の汚染について示した15)。調べた投与残液の計28サンプルのいずれもが102~108生菌数/mLの汚染を受けていたが、おもな汚染菌はアシネトバクターであった。
また図3には、使用中のネブライザー(超音波式およびジェット式)の計96台を対象として、薬液カップ内の吸入液の微生物汚染について示した17,18)。調べた96サンプル中36サンプル(37.5%)が10個/mL以上の汚染を受けていたが、これらの36サンプル中7サンプル(19.4%)からはアシネトバクターが検出された。
一方、表2には、化学療法施行中の口内炎予防に用いられるアロプリノール含嗽液(院内製剤、保存剤非含有)の投与残液の微生物汚染について示した22)。室温保管で7日間にわたって投与された15サンプルを対象としたが、いずれのサンプルも105個/mL以上の高濃度汚染を受けており、うち10サンプル(66.7%)からはアシネトバクターが検出された。患者が「薬剤部(薬局)から払い出される薬は微生物汚染を受けることはない」と勝手に判断して、冷所保存すべき薬を室温保管していることが少なくない。しかし、保存剤非含有であるアロプリノール含嗽液を室温保管で用いると、アシネトバクターなどの汚染を受けやすい。アロプリノール含嗽液の冷蔵庫保管は必須である。
図1. アシネトバクター汚染を受けやすい用具
| 「乾燥したつもり」の経管栄養剤の投与セット |  |
| 口腔ケア用品 |  |
| 吸引装置のチューブ |  |
| 24時間ごとの消毒が行われていないネブライザー (上:超音波式,下:ジェット式) |
 |
 |
|
| 人工呼吸器回路の結露水 |  |
| 超音波加湿器 |  |
| スポンジ |  |
| 剃毛用ハケ |  |
図2.「乾燥したつもり」の経管栄養バッグをくり返し使用した場合での投与残液の汚染菌とその検出頻度
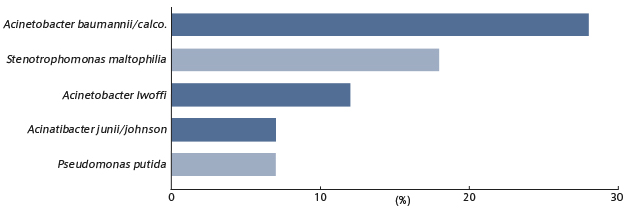
図3. ネブライザーの吸入液残液の汚染菌とその検出頻度
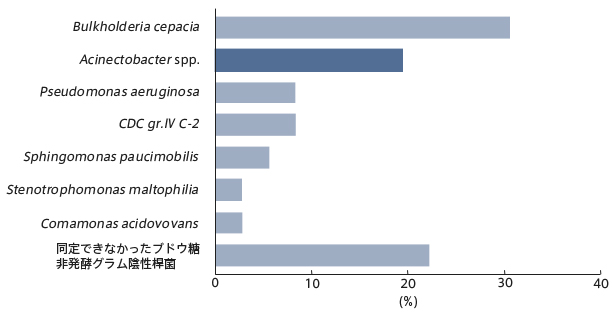
表1. 多剤耐性アシネトバクターの消毒例
| 経管栄養剤の投与セット | ・食器洗浄機(80℃・10秒間など)<円筒型投与容器> ・0.01%(100ppm)次亜塩素酸ナトリウムへ1時間浸漬<バッグ型投与容器,投与チューブ> |
|---|---|
| ネブライザー装置 (薬液カップ,蛇管など) |
・0.01%(100ppm)次亜塩素酸ナトリウムへ1時間浸漬 ・熱水(70℃・3分間や80℃・1分間など)<耐熱性の場合> |
| 口腔ケア用品 | ・0.01%(100ppm)次亜塩素酸ナトリウムへ1時間浸漬 ・熱水(70℃・3分間や80℃・1分間など)<耐熱性の場合> |
| 内視鏡 | ・高水準消毒薬での消毒→リンス→その後のチャンネル内のアルコールフラッシュ |
| ドアノブ | ・アルコール清拭 |
| 床頭台 オーバーテーブル |
・0.2%塩化ベンザルコニウムまたは0.2%両性界面活性剤で清拭 ・アルコール清拭 |
| リネン | ・熱水洗濯(70℃・10分間など) |
表2. アロプリノール含嗽液の投与残液の微生物汚染(n=15)
| サンプル番号 | 生菌数/mL | |
|---|---|---|
| 1 | 1.5×107 | Flavobacterium odoratum Acinetobacter baumannii Stenotrophomonas maltophilia Candida albicans |
| 2 | 8.8×106 | Brevundimonas vesiculasis Pseudomonas putida Acinetobacter baumannii Cryptococcus ald. rardif |
| 3 | 8.4×106 | Chryseobacterium indologenes Acinetobacter junii |
| 4 | 7.7×106 | Myroides spp. Acinetobacter baumannii Candida albicans |
| 5 | 7.1×106 | Acinetobacter baumannii Candida guilliermondii |
| 6 | 6.3×106 | Comamonas acidovorans Candida albicans |
| 7 | 5.5×106 | Sphingobacterium multivorum Acinetobacter baumannii |
| 8 | 4.9×106 | Acinetobacter junii |
| 9 | 3.3×106 | Acinetobacter baumannii Klebsiella pneumoniae Candida albicans |
| 10 | 3.0×106 | Pseudomonas putida Acinetobacter haemolyticus |
| 11 | 2.1×106 | Sphingomonas paucimobilis Sphingobacterium multivorum |
| 12 | 1.7×106 | Pseudomonas fluorescens Candida humiocola |
| 13 | 1.6×106 | Comamonasacidovorans Acinetobacter baumannii Candida parapsilosis |
| 14 | 5.1×105 | Pseudomonas fluorescens Sphingomonas paucimobilis Torulopsis candida |
| 15 | 3.5×105 | Stenotrophomonas maltophilia Candida parapsilosis |
引用文献
- Rosenthal SL: Sources of Pseudomonas and Acinetobacter species found in human culture materials. Am J Clin Pathol, 62: 807-811, 1974
- Bergogne-Bérézin E, et al: Epidemiology of nosocomial infections due to Acinetobacter calcoaceticus . J Hosp Infect, 10: 105-113, 1987
- Denton M, et al: Role of environmental cleaning in controlling an outbreak of Acinetobacter baumannii on a neurosurgical intensive care unit. J Hosp Infect, 56: 106-10, 2004
- El Shafie SS, et al: Investigation of an outbreak of multidrug-resistant Acinetobacter baumannii in trauma intensive care unit. J Hosp Infect, 56: 101-105, 2004
- Dettenkofer M, et al: Does disinfection of environmental surfaces influence nosocomial infection rates? A systematic review. Am J Infect Control, 32: 84-89, 2004
- Cozad A, et al: Disinfection and the prevention of infectious disease. Am J Infect Control, 31: 243-254, 2003
- Aygün G, et al: Environmental contamination during a carbapenem-resistant Acinetobacter baumannii outbreak in an intensive care unit. J Hosp Infect; 52: 259-262, 2002
- Vila J, et al: Laboratory investigation of hospital outbreak caused by two different multiresistant Acinetobacter calcoaceticus subsp. anitratus strains. J Clin Microbiol, 27: 1086-1089, 1989
- Holton J: A report of a further hospital outbreak caused by a multi-resistant Acinetobacter anitratus. J Hosp Infect, 3: 305-309, 1982
- Martró E, et al: Assessment of Acinetobacter baumannii susceptibility to antiseptics and disinfectants. J Hosp Infect, 55: 39-46, 2003
- Wang CY, et al: Pasteurization is effective against multidrug-resistant bacteria. Am J Infect Control, 34: 320-322, 2006
- Wisplinghoff H, et al: Resistance to disinfectants in epidemiologically defined clinical isolates of Acinetobacter baumannii . J Hosp Infect, 66: 174-781, 2007
- Kawamura-Sato K, et al: Reduction of disinfectant bactericidal activities in clinically isolated Acinetobacter species in the presence of organic material. J Antimicrob Chemother, 61: 568-576, 2008
- Kawamura-Sato K, et al: Correlation between reduced susceptibility to disinfectants and multidrug resistance among clinical isolates of Acinetobacter species. J Antimicrob Chemother, 65: 1975-1983, 2010
- Oie S, et al: Comparison of microbial contamination of enteral feeding solution between repeated use of administration sets after washing with water and after washing followed by disinfection. J Hosp Infect, 48: 304-307, 2001
- Yorioka K, et al: Microbial contamination suction tubes attached to suction instruments and preventive methods. Jpn J Infect Dis, 63: 124-127, 2010
- 河口忠夫, ほか: ジェットネブライザーの微生物汚染とその対策. 環境感染, 23: 221-223, 2008
- Oie S, et al: Microbial contamination of nebulization solution and its measures. Biol Pharm Bull, 29: 503-507, 2006
- 尾家重治, ほか: 超音波加湿器の微生物汚染. 防菌防黴, 16: 405-410, 1988
- Oie S, et al: Contamination and survival of Pseudomonas aeruginosa in hospital used sponges. Microbios, 105: 175-181, 2001
- Oie S, et al: Microbial contamination of brushes used for preoperative shaving. J Hosp Infect, 21: 103-110, 1992
- 尾家重治, ほか: アロプリノール含嗽液の微生物汚染とその対策. 薬剤学, 56: 119-125, 1996
- Oie S, et al: Microbial contamination of 'sterile water' used in Japanese hospitals. J Hosp Infect, 38: 61-65, 1998







