消毒薬の選び方
各種消毒薬の特徴
5.次亜塩素酸ナトリウム
特徴
次亜塩素酸ナトリウム(ピュリファン®など)は、強力な殺菌力を有する消毒薬である。
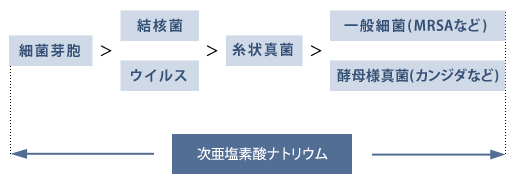
すなわち、本薬はグルタラール(ステリゾール®)などの高水準消毒薬と同様に芽胞を含むすべての微生物に効力を示す(図11)1,2)。
ただし、本薬は汚れ(有機物)で不活性化されて効力低下が生じやすいため3,4)、中水準消毒薬に分類される。
図11. 微生物の消毒薬抵抗性の強さ、および次亜塩素酸ナトリウムの抗菌スペクトル
消毒対象
(1)「食」関連の用具
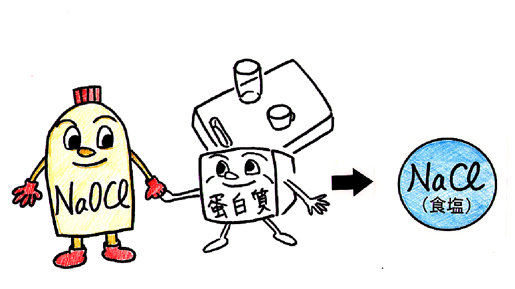
次亜塩素酸ナトリウムは蛋白質などの有機物と反応すると食塩に変化する(図12)。
すなわち、本薬は低残留性である。したがって本薬は、ほ乳瓶、投薬容器、および経腸栄養剤の投与セットなどの「食」関連用具の消毒に適している。
これらの用具を洗浄後に、0.01%(100ppm)液へ1時間以上浸漬させる。
たとえば、経腸栄養剤の投与セット(投与バッグと投与チューブなど)は、使用のつど水洗いして、次回使用時まで0.01%(100ppm)液へ浸漬しておく。そして、次回使用時には、液切りを行ってから用いる5)。
図12. 次亜塩素酸ナトリウムは食塩に変化するため、「食」関連用具の消毒に適している
(2)リネン
次亜塩素酸ナトリウムは安価で、かつ塩素ガス(Cl2)として蒸発する特徴がある。
すなわち、本薬は生地に残らない。したがって本薬は、色・柄物でないリネン類の消毒に適している。
リンス(すすぎ)工程後に、0.02%(200ppm)液へ5分間以上浸漬し、その後にふたたび水洗する。
ただし、O157汚染の下着などの場合で、洗濯時に微生物への暴露の危険性があれば、洗濯前にも0.1%(1,000ppm)液への30分間浸漬を行う。
なお本薬は、毛・絹・ナイロン・ポリウレタンや色・柄物の消毒には適さない。
(3)「呼吸器」関連のプラスチック器材
超音波ネブライザー(図13)は、クロルヘキシジン(ヒビテン®、マスキン®)や塩化ベンザルコニウム(オスバン®、ザルコニン®)が無効なセパシア菌(Burkholderia cepacia)で汚染を受けやすい。
したがって、超音波ネブライザーの蛇管や薬液カップなどの消毒には、セパシア菌にも有効でかつ低残留性の次亜塩素酸ナトリウムが適している7)。
洗浄後に0.01%(100ppm)液への1時間浸漬を行う。なお、本薬は若干のプラスチック劣化作用があるので、頻回の適用で蛇管などの劣化が生じる場合がある。
図13. 超音波ネブライザー

蛇管などの消毒には次亜塩素酸ナトリウムが適している。
(4)ウイルス汚染血液
次亜塩素酸ナトリウムは抗ウイルス作用を示すので(図11)、B型肝炎ウイルスやC型肝炎ウイルスなどの汚染血液の消毒に使用できる8,9)。
0. 1%(1,000ppm)液含浸ガーゼ(レーヨン製)などでの2度拭きを行う(図14)。
図14.ウイルス汚染血液の消毒

(5)環境
次亜塩素酸ナトリウムは、MRSAなどの一般細菌のみならず、ノロウイルスやクロストリジウム・ディフィシル(偽膜性大腸炎の病原菌)の芽胞で汚染された環境の消毒にも有効である。
一般細菌には0.01%(100ppm)液での、またウイルスや芽胞には0.1%(1,000ppm)液での清拭を行う。2度拭きが望ましい。
取り扱い上の留意点
次亜塩素酸ナトリウムは金属腐食性が強いので、金属製用具の消毒には適さない。
また、本薬から発生する塩素ガスは眼や呼吸器系の粘膜を刺激するので、開放容器(フタなし容器)での使用や、窓の開放が行えない場合での床などの広範囲清拭は控えたい。
さらに、本薬は汚れ(有機物)で効果低下が生じやすいので、ほ乳瓶などの消毒では前もっての十分な洗浄が必要になる。
引用文献
- 小林晃子、尾家重治、神谷 晃:高水準消毒薬の殺芽胞効果に及ぼす温度および有機物の影響。環境感染、21:236-240、2006。
- 尾家重治、神谷 晃:細胞芽胞に対するミルトン®の消毒効果。医学と薬学、1997;38(1)、85-87。
- Coates D: A comparison of sodium hypochlorite and sodium dichlo-roisocyanurate products. J. Hosp. Infect. 1985; 6, 31-40.
- 4) Coates D: Conparison of sodium hypochlorite and sodium dichloro-isocyanurate disinfectants: neutralization by serum. J. Hosp. Infect. 1988; 11, 60-67.
- Oie S, Kamiya A, Hironaga K, at al: Microbial contamination of enteral feeding solution and its prevention. Am. J. Infect. Control. 1993; 2, 34-38.
- Oie S, Kamiya A: Comparison of microbial contamination of enteral feeding solution between repeated use of administration sets after washing with water and after washing followed by disinfection. J. Hosp. Infect. 2001; 48, 304-307.
- Oie S, Makieda D, Ishida S, at al: Microbial contamination of nebulization solution and its measures. Biol. Pharm. Bull. 2006; 29, 503-507.
- Tsiquaye K N, Barnard J: Chemical disinfection of duck hepatitis B virus: a model for inactivation of hepatitis B virus. J. Antimicrob. Chemother. 1993; 32, 313-323.
- Barnard S F, Smith-Burchnell C A, Dalgleish A G: Evaluation of hypochlorite-releasing disinfectants against the human immunoDe-ficiency virus (HIV). J. Hosp. Infect. 1990; 15, 237-278.







